近日,我校基础医学与临床药学学院徐澍特聘研究员团队与司马健教授/徐翀副研究员团队、赵灵之教授/彭娟娟教授团队合作,在“新型基因编辑工具及药物研发”方向取得研究进展,成果已发表于期刊Genome Biology和Biomaterials。
阿尔茨海默病(AD)是发病率最高的神经退行性疾病,生物技术药物为其治疗带来了希望。敲减淀粉样前体蛋白APP突变基因,可减少脑内β淀粉样蛋白的产生。然而,由于野生/突变型基因仅差异1-2个碱基,特异性不高的RNAi技术,会误伤野生型APP,影响神经细胞正常功能。
徐澍团队着手构建了一种新型RNA编辑工具TaqTth-hpRNA,由向导RNA探针(hpRNA)引导重组FEN1类功能蛋白(TaqTth,832aa),在靶标RNA上进行高特异性识别切割,无PFS固定碱基搭配模式要求。由于尺寸紧凑,AAV装载后仍有充足空间,司马健/徐翀团队提出在破坏“致病基因”APP的基础上,可追加过表达一种“抗病基因”APOE2,用单一AAV装载递送,双管齐下,组合治疗AD。实验证明治疗后的5×FAD小鼠的β淀粉样蛋白水平显著降低,行为学指标、病理学指标均有明显改善。
该研究以“TaqTth-hpRNA: a novel compact RNA-targeting tool for specific silencing of pathogenic mRNA”为题,发表在Genome Biology上,中国药科大学兴药副研究员徐翀、博士生曹吉娅诺、硕士毕业生强焕然对本文做出了主要贡献。
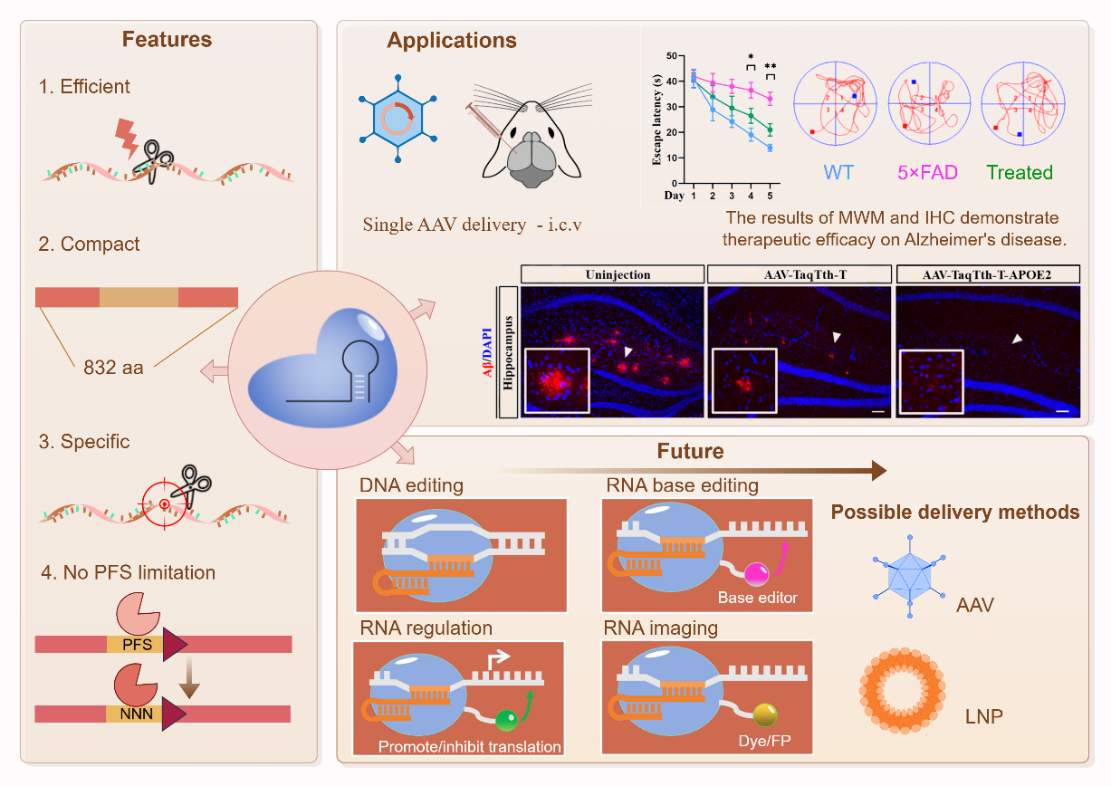
示意图(全文链接如下:https://doi.org/10.1186/s13059-024-03326-3)
肝纤维化是一系列终末期肝脏疾病的前奏,目前临床上没有针对肝纤维化的一线药物。徐澍团队着手构建了一种新型RNA编辑工具HpSGN,由向导DNA探针(hpDNA)引导瓣状核酸内切酶-1(Flap endonuclease 1,FEN1,330aa),在靶标RNA上进行高特异性识别和高效切割,对靶标无PFS固定碱基搭配模式要求,具有紧凑尺寸。赵灵之/彭娟娟团队通过自组装构建了氧化硅交联的聚合物胶束(SCLMs),在其表面修饰肝星状细胞靶向肽,从而抑制其活化,阻止胶原生成。
团队基于HpSGN技术和SCLMs载体,成功利用基因/化学药物的联合治疗逆转肝纤维化。载体表面修饰连接FEN1核酸酶和hpDNA探针,特异性切割TIMP1基因的mRNA,使TIMP-1蛋白表达降低以促进ECM降解,核糖核蛋白复合物无需在体表达,起效更快,且不会重组入基因组;同时载体内核包载疏水性药物罗格列酮,使肝星状细胞失活,双管齐下,通过促进胶原降解和抑制胶原生成的双向调控作用成功逆转小鼠肝纤维化,逆转效率高达90%,有望解决肝纤维化的临床用药匮乏的现状。
该研究以“Reversal of hepatic fibrosis by the co-delivery of drug and ribonucleoprotein-based genome editor”为题发表在Biomaterials上,中国药科大学硕士毕业生顾家玉、博士毕业生田坤对本文做出了主要贡献。
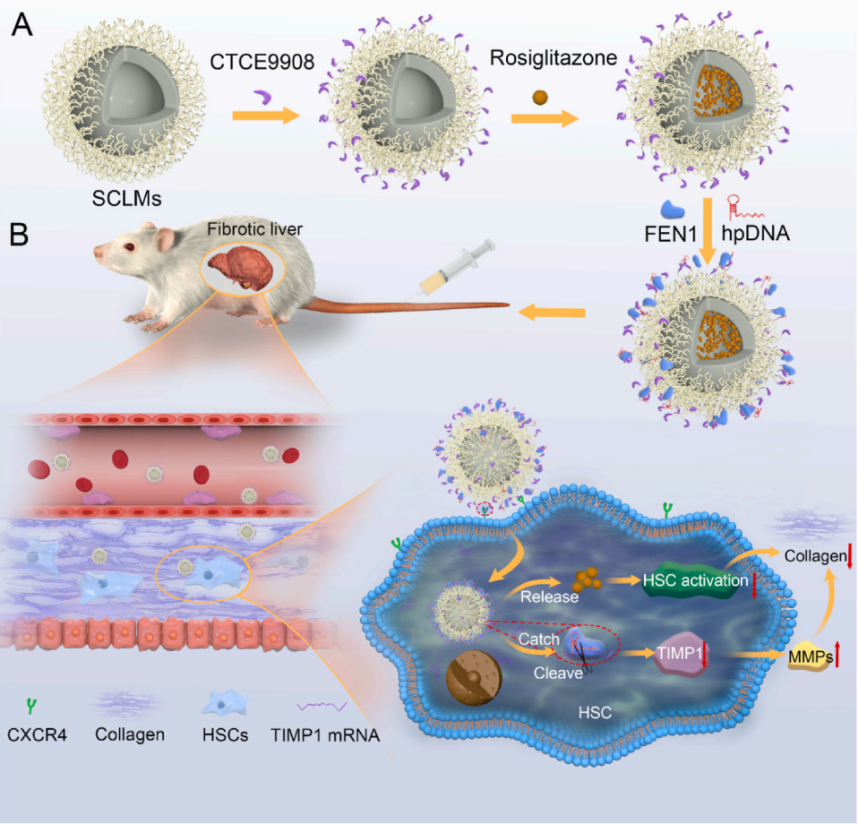
示意图(全文链接如下:https://doi.org/10.1016/j.biomaterials.2023.122133)
目前徐澍研究员团队聚焦于开发多元化、全方位的新型基因编辑技术,并与优秀的合作伙伴一起,攻关递送、药效、药理学等难题,针对肝、肺和脑等器官疾病研发新型基因靶向药物,相关研究成果已获授权专利3项。
(供稿单位:基础医学与临床药学学院 撰稿人:仲忆雯,审稿人:沈玲玲、郑诗翌)






