北京时间12月13日,我校药学院药理系、重庆中国药科大学创新研究院、多靶标天然药物全国重点实验室肖易倍教授,药学院药理系陈美容副教授,生命科学与技术学院陆美玲副教授合作在Science杂志上以“First Release”形式在线发表了题为Antiviral signaling of a type III CRISPR-associated deaminase的研究论文。肖易倍教授、陈美容副教授、陆美玲副教授为该论文的通讯作者。药学院博士研究生李钰涛、博士后李兆星,药学院硕士研究生闫朴睿、孔健平,以及生命科学与技术学院硕士研究生华晨扬为该论文的共同第一作者。中国药科大学为该论文的唯一通讯单位。
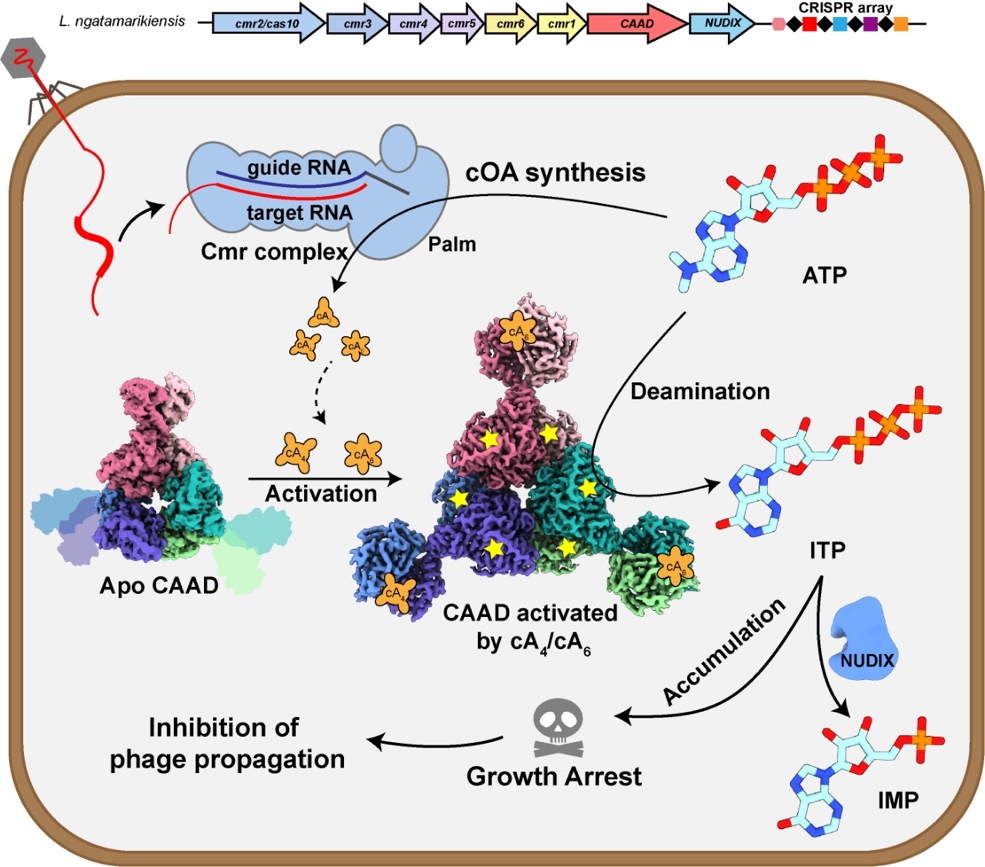
CRISPR-Cas系统是原核生物中广泛存在的一种由RNA引导靶向外源遗传物质的核酸免疫系统。基于II型CRISPR-Cas9的基因编辑技术,获得2020年诺贝尔化学奖,并在生物医药等诸多领域产生了革命性的影响。而III型CRISPR-Cas系统是目前发现的所有CRISPR-Cas系统中最复杂的一类系统,阐明其作用机制具有重要的科学意义和潜在的应用价值。不同于其余Cas系统直接靶向并切割外源核酸,III型CRISPR-Cas系统识别外源核酸后会合成第二信使环化腺苷(cAn)来激活下游效应核酸酶的非特异性切割活性,从而实现免疫。但该团队前期通过生物信息学分析挖掘到一类III型CRISPR-Cas下游缺失了广泛分布的核酸酶模块,取而代之的是一个融合了第二信使识别结构域的脱氨酶CAAD,以及一个可能降解核苷的水解酶Nudix。表明该类系统的作用机制可能完全不同于已知的通过切割核酸实现免疫的CRISPR-Cas系统。鉴于合成环化核苷酸第二信使和腺苷脱氨分别在人源核酸免疫系统cGAS-STING和ADAR中存在,该团队大胆推测这类系统很可能是通过核苷酸代谢来实现其免疫效应。为了证明这一假设,团队成员通过体外重组,首先证明该系统效应复合物Cmr识别外源核酸后会利用ATP为底物合成cA3/cA4/cA6三种环化腺苷。其中cA4和cA6可做为第二信使特异性激活CAAD的脱氨酶活性,将ATP转变成ITP, 迅速导致ATP耗竭从而抑制被感染细菌的生长。但ITP的蓄积往往会导致较强的细胞毒性,团队进一步证明了水解酶Nudix可特异性地将ITP降解成IMP,并通过这一解毒效应恢复细菌生长。为了阐明cA4/cA6如何激动CAAD并将ATP脱氨生成ITP的分子机制,团队利用冷冻电镜捕捉到了CAAD从无活性到被激活过程中一系列的高分辨率三维结构,直接观察到并证实了其激活过程中存在协同效应。该项研究发现了核酸免疫系统中一条全新的核苷代谢-免疫调控-抗病毒通路,并阐明了其具体的分子机制,为开发III型CRISPR系统作为应用工具打下重要的理论基础。
近三年,团队成员聚焦核酸免疫与调控,以通讯作者(含共同通讯作者)在Science、Nature Chemical Biology、Cell Research、Nature Communications、PNAS、NAR、Cell Reports、APSB和JMC等学科顶尖及以上期刊发表研究论文近30篇,申报专利50余项。在本课题开展过程中,团队积极依托学校有组织科研体系,通过与生命科学与技术学院陈依军教授、药学院药物化学系杨鹏教授、药物分析系纪顺利副教授、中药学院赵玉成教授、湖南中医药大学李顺祥教授、新加坡国立大学胡纯一教授、南京财经大学李光磊博士等团队联合攻关,最终得以顺利完成本课题。生命科学与技术学院硕士研究生吴宛倩和崔钰瑢,湖南中医药大学博士研究生段彦亦参与了本课题研究。
该研究工作得到了国家自然科学基金创新研究群体项目(82321005)、国家重点研发计划(2023YFC3402300)、江苏高校优势学科建设工程第四期(1132210017)等项目的支持。上海交通大学分析测试中心和南方科技大学冷冻电镜平台为数据采集提供了重要支撑。
全文链接:https://www.science.org/doi/10.1126/science.adr0393
示意图
(供稿单位:药学院、生命科学与技术学院,撰写人:肖星宇,审稿人:刘帆、郑诗翌)





